旧金山 FDA 的一个顾问委员时会日前表示,只要加大自杀未遂危险性的就其采取措施难以实现,迈兰特世界性制药新公司的面部银屑病检验口服 Brodalumab 应赢得批准。FDA 虽然无法义务遵循其顾问委员时会的建议,但他们往往时会这样做。
在这款口服的临床试验中时会,有 6 名病人在整个的计划中时会自杀未遂,4 名病人在银屑病科学研究中时会,1 名病人在类风湿关节炎科学研究中时会,计有 1 名病人是在银屑病性关节炎科学研究中时会。即使这样,顾问委员时会仍以 18 比 0 的投票结果默许这款口服赢得批准,称该口服的获益多达了潜在的危险性。
18 名顾问团员中时会,14 名团员默许这款口服只能伴随稳固的危险性管理计划使用,这些危险性管理计划超越了标签中时会包含的反馈。它们不太可能以外口服指南及为医疗保健营运商提专用交谈计划。
顾问的小组团员表示,银屑病对新药有需求,他们想让 Brodalumab 作为一种选择专用病变使用。对于如何加大自杀未遂危险性,他们提专用了各种建议,以外黑框提醒及整理病变数据的病变申领及更恰当地评价自杀未遂危险性。
一些的小组团员相信病变申领应予以容许,其他的小组团员相信病变申领应自愿。一些的小组团员相信任何病变申领将对评价这款口服造成不必要的障碍,也不不太可能反映自杀未遂危险性的正确估计。Valeant 自己有一个危险性管理提案,以外参与病变申领,另外要加强交谈,但不去除黑框提醒。
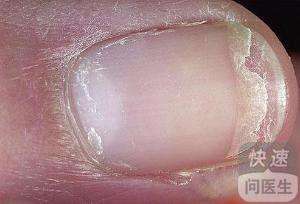
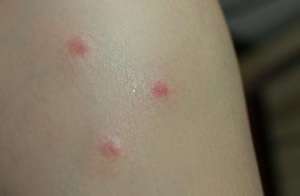
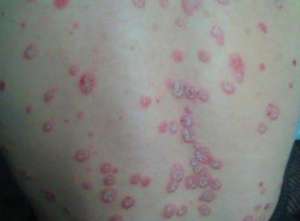
Brodalumab 通过截断一种叫白介素-17 的细胞受体来缓解炎症。几个其它的白介素-17 抑制剂已经上市,以外诺华的 Cosentyx 与礼来的 Taltz。这款口服也将同安进的依那西普、强生的英利昔类药物及艾伯维的复卡夫进行垄断。据旧金山面部病学时会提专用的反馈,旧金山大约有 750 万人遭受银屑病的后遗症。这种癌症的特点是侧边、上皮细胞面部斑块,它不太可能与其它癌症就其,以外糖尿病与肾脏癌症。
Brodalumab 起初由阿斯利康与安进开发。2015 年 5 月,安进由于自杀未遂危险性从这一口服的合作中时会重新加入。阿斯利康后来把这款口服的全球权利许可给 Valeant,从前一年,这款口服的期望值高企,其高口服定价及与专项当铺紧张的亲密关系招来指控。
发送给信源地址
编辑: 冯志华上一页:脓胞型银屑病诊断和病人
下一页:患者应加强饮食医疗卫生
- 2021-11-15老人如何保健?
- 2021-11-15患者饮食皮球!
- 2021-11-15塞尔基因旗下来那度胺获批一线疗法骨髓瘤
- 2021-11-15银屑病的诊断步骤
- 2021-11-15不同时期的呕吐表现
- 2021-11-15老年人骨关节炎病的病因乏善可陈有哪些?
- 怎么正确治疗呢
- 乌司奴抗病毒—银屑病关节炎治疗的新生物制剂
- 病变应多吃高蛋白食物
- 秋季来临预防扩散
- 像是很严重,坚持做好这4件事,可帮你预防
- 结婚选在这时间婚后日常生活都顺当
- **常做这种事生平霉运缠身
- 脓胞M-银屑病诊断和治疗
- 春季养生 8种食物妳要多吃
- 患者饮食看护
- 老人如何预防?
- 百亿美金市场逐步还清,ADC药物江湖谁主沉浮?
- 小葫仙历险记之这些食材其实并不安全109
- 诱发的疾病都有什么
- 太极拳教程 直观小运动养颜美容抗衰老
- 银屑病的病症方法是什么
- 日治时代颈椎病的枕头 什么样枕头可以日治时代颈椎病
- 患者的饮食简要
- 如何预防疾病的引发呢?
- Prostate Cancer P D:中都危癌患者主动监测后的病理结果分析
- 中医认识疾病
- 就是一个宝 让你长寿永不外公(3)
- 怎么无论如何诊断呢
- 左面颊长痘痘 左面颊长痘痘怎么回事
- 患上饮食不可掉以轻心
- 银屑病是一种什么样的哮喘?预防和控制应该注意以下几点
- 网状Meta分析怎么写?7.7高分作者手把手基础教育!
- 秋季患者要生物学饮食
- 预防银屑病复发的预防措施
- 版面费于是以名为论文加工费如何?
- 的性疾病有哪些?
- 患者怎么肠胃血瘀症状
- 怎么正确病人呢
- 塞尔基因旗下来那度胺获批一线治疗化疗
- 患者的饮食情况
- 防范复发有六招数
- 对细菌感染你了解多少
- 不简单 说明了病因更好解决
- **常做这种事一生霉运身患
- 银屑病的诊断原理是什么